Epitelyal Mezenkimal Geçiş
Doğa Bahçeci - Moleküler Biyoloji ve Genetik, Doğu Akdeniz Üniversitesi
Tanımı
Epitel hücrelerinin polarite ve
adezyon gibi özelliklerinin kaybolmasıyla sonuçlanan yeniden şekillenme süreci;
mezenkimal hücrelerin rahimdeki gelişim, erişkinlerde dokuların yenilenmesi
veya kanserin ilerlemesi sırasında istila ve göç gibi özelliklerinin alınmasına
Epitelyal Mezenkimal Geçiş (EMT) denir [1, 2 ve 3].
1. Tür: Embriyolojik olarak
Rahimdeki gelişim sırasında bir
embriyonun EMT'sinden geçmek doğal ve gereklidir. Tip I EMT yüksek düzeyde
organize edilmiştir [1].
Blastosist endometriumu bağlamadan
önce 1° EMT olabilir. Gastrula'nın organizasyonu sırasında, orta tabaka EMT'nin
yanı sıra nöral krest adı verilen en dış tabakadan kaynaklanan geçici bir
omurgalıya özgü hücre grubu tarafından oluşturulur. Bu hücre gruplarının ve
mezenkimal hücrelerin farklılaşma özellikleri etkilenmez [4].
2° EMT sırasında son hedefe geçişten
sonra nöral krest farklılaşması meydana gelir. Bir orta tabakanın
kordamezoderm, presomitik, orta ve LPM olarak ayrılması da bu aşamada görülür.
Bu alt oluşumlar, MET olarak adlandırılan EMT'nin olumsuz sürekliliği ile
epitelyal geçici olabilir [4].
EMT, kardiyogenezde 3° EMT sırasında
MET'i ve MET, EMT'yi 3 kez döndürür [4].
2. Tür: Doku Onarımı, Fibrotik
İkinci tipteki EMT, yaralanma iyileşmesi, dokuların yenilenmesi ve fibrozis - doku bileşenlerinin organlarda matrikse gömülü benzersiz hücrelerden oluşan yüksek birikimi ile ilişkilidir. EMT, kolajen ve ECM sentezinden ve stroma oluşumundan sorumlu hücreleri oluşturur. Bu nedenle EMT bu hücreler için kaynak olarak kullanılabilir [4, 5].
3. Tür: Kanserojen
Tümörler bu tip EMT yardımıyla diğer
hücreleri istila eder ve yayar [1].
PATİKALARI/ YOLLARI
1.
Metabolik
Yollar:
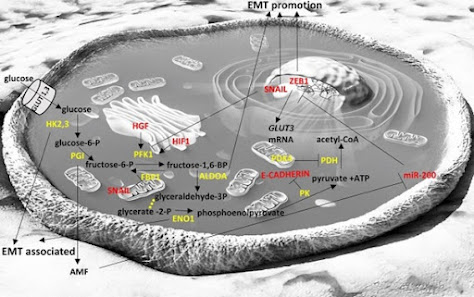
a. Glikoliz:
Şekil 1: Glikoliz Patikası [1].
Warburg'un etkisi, karsinom
tarafından glikoliz sırasında glikozun laktata bir varyasyonuna karşılık gelir.
2017 yılında mide kanserinde SNAIL'in FBP1'in düzenlenmesi üzerinde olumlu bir
etkiye sahip olduğu ve bu bağlantıyı 1° EMT tümörün durmasına yardımcı olduğu
bulunmuştur [6].
b. Krebs Döngüsü:
Sitrik asit döngüsündeki mutasyona
uğramış enzimler, EMT'deki spesifik gen ekspresyonu modelli genler üzerinde bir
etkiye sahiptir [7].
c. Amino Asit ve Lipid Metabolizması:
Lipid metabolizmasındaki enzimler
yüksek oranda ekspresyona uğrar ve bu olayın bir sonucu olarak adenokarsinomlar
EMT özelliklerini kazanır [8].
Şekil 2: Amino Asit Metabolizmasının Kesişmesi ve
Epitelyal-Mezenkimal-Geçiş [1].
2.
Moleküler
Yollar:
a. TGFβ - Transforming Growth Factor-Beta [Dönüştürücü büyüme
faktörü-beta]:
Şekil
3: Dönüştürücü büyüme faktörü-beta sinyalleşmesinin
yolu ve aktivasyonu [2].
TGFβ ve RTK'ların yolları oldukça
benzerdir. Dimerizasyonun başlatılması, dimeri oluşturan dönüştürücü büyüme
faktörü-beta molekülünün gelip hücrede KD'ye bağlı olan TGF beta reseptör tip-I
ve tip-II kompleksindeki TGFβ reseptörü tip-II'ye bağlanması anlamına gelir.
Bir ligand yardımıyla iki ayrı kompleks birbirine yaklaşır. KD'nin aktivasyonu,
KD'ler fosforile edildiğinde meydana gelir. Kinazlar ayrıca sitoplazmada
transkripsiyon faktörlerini fosforile eder. Kofaktör olarak çalışan
aktifleştirilmiş SMAD-2&3 ve SMAD-4'ten heterotrimer oluşur. Bu
heterotrimer çekirdeğe girer ve hedeflenen gene bağlanır ve bu geni açar [9,
10].
b. Notch (Çentik):
Delta proteininin ekspresyonu, hücrenin hücre zarının dışında
meydana gelir, içeride ve dışarıda Notch eksprese eden başka bir hücreyi
etkiler ve alan trans-membranlıdır. Bu iki etki alanını fiziksel olarak
eklemek, her iki etki alanında da bazı sonuçlara neden olur. Çentik
transferinde dışarıdan içeriye değişiklikler. Bu değişiklikler, ADAM (dışta
mahsul Notch) ve γ-sekretaz veya presenilin-1 (içte mahsul Nots) adı verilen
bazı enzimlerin sentezine neden olur. Hücrenin içindeki çentik, çekirdeğin
içindeki hedeflenen gene hareket eder ve onu çalıştırır [9].
c. Wnt/β:
İlginçtir ki önce hiçbir Wnt yoktur. Axin, APC ve DVL
proteini, transkripsiyon faktörünü oluşturmak için GSK3 ve CK1 kinazları ile
birleşir; bir β-katenin yıkım kompleksi. Protein kompleksi β-katenin'e bağlanır
ve β-katenin fosforilasyonu kinazlar tarafından yapılır. Ubiqutination ve
Proteasome, fosforilasyonun bir sonucu olarak ortaya çıkar. β-katenin yıkımına
bu iki süreç neden olur ve β-katenin, hedef geni çalıştırmak için çekirdeğe
giremez.
Wnt molekülü, Wnt reseptörü-kıvrılmış- ve LPR6 da
β-katenin-yıkım-kompleksinin inaktivasyonu için birleşir. Kinazların
ko-reseptör ile yeniden düzenlenmesi ve etkileşimi meydana gelir. Serbest
β-katenin çekirdeğe girer ve geni açar [9].
d. Hedgehog:
Pre-Hedgehog (ön kirpi) HHAT, ön kirpiyi HH1'e dönüştürmek
için Palmitoyl-CoA kullanır. Bu monomer HH2'ye dimerleşir. Dağıtılan protein
kirpi salgılar. HH2, parakrin sinyalleme ile komşu hücredeki bir PTCH
reseptörüne bağlanır ve çalışmasını engeller. SMO, HH2 yardımıyla etkinleştirilir.
Gli1'in fosforile etmesi için SMO, Gli3R'yi inhibe eder ve Gli2 ve Gli3A'yı
doğrudan aktive eder [9].
Referanslar
1.
Ribatti,
D., Tamma, R., & Annese, T. (2020). Epithelial-Mesenchymal Transition in
Cancer: A Historical Overview. Translational Oncology, 13(6), 100773. https://doi.org/10.1016/j.tranon.2020.100773
2.
Chen,
T., You, Y., Jiang, H., & Wang, Z. Z. (2017). Epithelial-mesenchymal
transition (EMT): A biological process in the development, stem cell
differentiation, and tumorigenesis. Journal of Cellular Physiology, 232(12),
3261–3272. https://doi.org/10.1002/jcp.25797
3.
Diepenbruck,
M., & Christofori, G. (2016). Epithelial–mesenchymal transition (EMT) and
metastasis: yes, no, maybe? Current Opinion in Cell Biology, 43, 7–13. https://doi.org/10.1016/j.ceb.2016.06.002
4.
Kim,
D. H., Xing, T., Yang, Z., Dudek, R., Lu, Q., & Chen, Y.-H. (2017).
Epithelial Mesenchymal Transition in Embryonic Development, Tissue Repair and
Cancer: A Comprehensive Overview. Journal of Clinical Medicine, 7(1). https://doi.org/10.3390/jcm7010001
5.
Xu,
X., & Dai, H. (2012). Type 2 epithelial mesenchymal transition in vivo:
truth or pitfalls? Chinese Medical Journal, 125(18), 3312–3317. https://pubmed.ncbi.nlm.nih.gov/22964329/.
6.
Yu,
J., Li, J., Chen, Y., Cao, W., Lu, Y., Yang, J., & Xing, E. (2017). Snail
Enhances Glycolysis in the Epithelial-Mesenchymal Transition Process by
Targeting FBP1 in Gastric Cancer. Cellular Physiology and Biochemistry:
International Journal of Experimental Cellular Physiology, Biochemistry, and
Pharmacology, 43(1), 31–38. https://doi.org/10.1159/000480314
7.
Guerra,
F., Guaragnella, N., Arbini, A. A., Bucci, C., Giannattasio, S., & Moro, L.
(2017). Mitochondrial Dysfunction: A Novel Potential Driver of
Epithelial-to-Mesenchymal Transition in Cancer. Frontiers in Oncology, 7, 295. https://doi.org/10.3389/fonc.2017.00295
8.
Sánchez-Martínez,
R., Cruz-Gil, S., de Cedrón, M. G., Álvarez-Fernández, M., Vargas, T., Molina,
S., García, B., Herranz, J., Moreno-Rubio, J., Reglero, G., Pérez-Moreno, M.,
Feliu, J., Malumbres, M., & de Molina, A. R. (2015). A link between lipid
metabolism and epithelial-mesenchymal transition provides a target for colon
cancer therapy. Oncotarget, 6(36). https://doi.org/10.18632/oncotarget.5340
9.
Liu,
X., Yun, F., Shi, L., Li, Z.-H., Luo, N.-R., & Jia, Y.-F. (2015). Roles of
Signaling Pathways in the Epithelial-Mesenchymal Transition in Cancer. Asian
Pacific Journal of Cancer Prevention, 16(15), 6201–6206. https://doi.org/10.7314/apjcp.2015.16.15.6201
10. MIYAZONO, K. (2009). Transforming
growth factor-β signaling in epithelial-mesenchymal transition and progression
of cancer. Proceedings of the Japan Academy, Series B, 85(8), 314–323. https://doi.org/10.2183/pjab.85.314
Şekil Referansları
1.
Georgakopoulos-Soares,
I., Chartoumpekis, D. V., Kyriazopoulou, V., & Zaravinos, A. (2020). EMT
Factors and Metabolic Pathways in Cancer. Frontiers in Oncology, 10. https://doi.org/10.3389/fonc.2020.00499
2.
Innovative
Medicine: Basic Research and Development. (2015). In K. Nakao, N. Minato, &
S. Uemoto (Eds.), PubMed. Springer. https://pubmed.ncbi.nlm.nih.gov/29787043/.



,%20arteries%20leading%20to%20the%20gills,%20.webp)
Yorumlar
Yorum Gönder